प्रेरणिक प्रभाव किसे कहते हैं ? Inductive effect प्रेरणिक प्रभाव को उदाहरण सहित समझाइए
inductive effect examples प्रेरणिक प्रभाव किसे कहते हैं ? प्रेरणिक प्रभाव को उदाहरण सहित समझाइए ?
अभिकर्मक के प्रकार –
आपकी जानकारी के लिए आपको बता दे कि अभिकर्मक मुख्य रूप से तीन प्रकार के होते है |
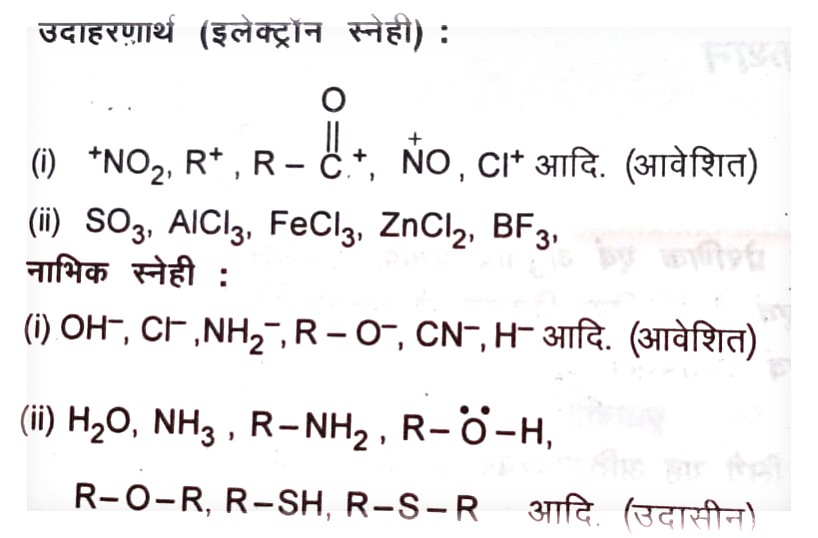
- इलेक्ट्रान आकर्षी अथवा इलेक्ट्रॉन स्नेही अभिकर्मक
- नाभिक आकर्षी अथवा नाभिक स्नेही अभिकर्मक
- उभयधर्मी
उदाहरणार्थ (इलेक्ट्रॉन स्नेही) :
 |
| Inductive effect |
उभयधर्मी : वे अभिकर्मक जो किसी अभिक्रिया में इलेक्ट्रॉनस्नेही और नाभिक स्नेही दोनों का कार्य करने में सक्षम होते है उन्हें उभयधर्मी अभिकर्मक कहते है |
नाभिक स्नेहिता या क्षारीयता
परिभाषा : कार्बन परमाणुओं के साथ बंध बनाने की प्रवृत्ति को नाभिक स्नेहिता कहा जाता है जबकि दूसरी तरफ प्रोटोन के प्रति आकर्षण को क्षारीयता द्वारा व्यक्त किया जाता है | अत: कहा जा सकता है कि कार्बन परमाणुओं से बंध बनाने की प्रकृति को नाभिक स्नेहिता एवं प्रोटोन के प्रति आकर्षण को क्षारीयता बोला जाता है |
अभिकर्मको के गुणों के आधार पर हम कह सकते है कि नाभिक स्नेहिता रासायनिक बलगतिकी गुणधर्म होता है जो किसी अभिक्रिया के वेग से सम्बन्धित होता है जबकि दूसरी तरफ क्षारीयता ऊष्मागतिकी गुणधर्म होता है जो अभिक्रिया की साम्यावस्था पर निर्भर करता है |
नाभिक स्नेहिता का क्रम निम्नलिखित प्रकार से होता है –
Et – O– > OH0 > Ph O– > Cl– > Me3N
हेलोजनों में नाभिक स्नेहिता का क्रम निम्ननुसार होता है –
I– < Br – < Cl– < F–
आवर्ती सारणी के आवर्तों में क्षारीयता और नाभिक स्नेहिता में परिवर्तन समान रूप से पाया जाता है |
जबकि वर्ग में ऊपर से नीचे की तरफ जाने पर नाभिक स्नेहिता बढती है लेकिन क्षारीयता का मान घटता जाता है
|
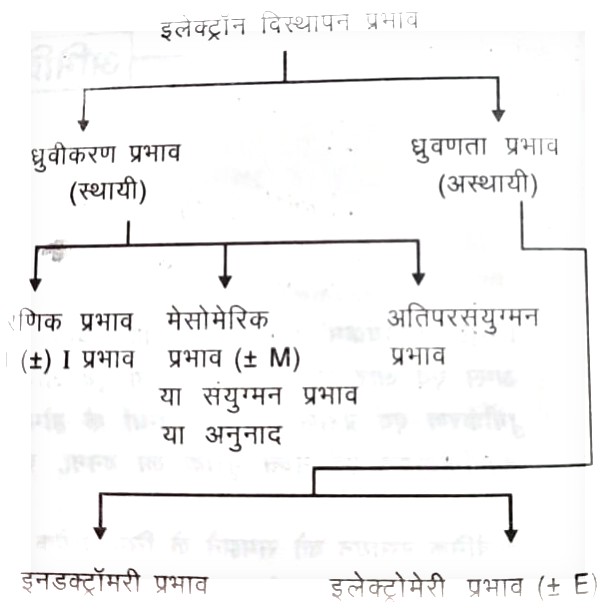
कार्बनिक अणुओं में इलेक्ट्रॉन विस्थापन –
प्रेरणिक प्रभाव किसे कहते हैं ?
- प्रेरणिक प्रभाव एक प्रकार का स्थायी प्रभाव होता है जो ध्रुवीय सहसहसंयोजक बंधों द्वारा प्रदर्शित किया जाता है |
- ध्रुवीय सहसंयोजक बंधों में इलेक्ट्रॉन युग्म दोनों बंधित परमाणु के बीच अवस्थित नहीं होते है बल्कि अधिक विद्युतऋणी परमाणु की तरफ आकर्षित होते है इसलिए किसी भी कार्बन की श्रृंखला में ध्रुवीय सहसंयोजक बंध की उपस्थिति के कारण होने वाले इलेक्ट्रॉन विस्थापन की प्रक्रिया की प्रेरणिक प्रभाव अर्थात आई इफ़ेक्ट कहलाता है |
नोट : यहाँ ध्यान देने वाली बात यह है कि प्रेरणिक प्रभाव के अंतर्गत इलेक्ट्रॉन का एक परमाणु से दुसरे परमाणु पर वास्तविक स्थानांतरण नहीं पाया जाता है |
प्रेरणिक प्रभाव के प्रकार –
- + I प्रभाव
- – I प्रभाव
- हाइड्रोजन को R3C-H अणु में मूल मानकर
i.e. (CH3)3C –H
(ii) यदि इस अणु का हाइड्रोजन परमाणु ,Z समूह के द्वारा प्रतिस्थापित करने पर अणु के R3C भाग का इलेक्ट्रॉन घनत्व R3C—H भाग से कम हो तो z समूह , I प्रभाव प्रदर्शित करता है |
- यदि R3C भाग का इलेक्ट्रॉन घनत्व R3C-H भाग से अधिक हो तो Z समूह +I प्रभाव प्रदर्शित करता है |
- + I प्रभाव : यह प्रभाव इलेक्ट्रॉन दाता समूह की उपस्थिति से उत्पन्न होता है | ऐसे समूह 3 डिग्री कार्बन से जुड़े हाइड्रोजन की तुलना में इलेक्ट्रॉनों को अपनी तरफ प्रबल रूप से आकर्षित करते है |
-O– > (CH3)3C – > (CH3)2CH- > CH3-CH2– > CH3– > D > H
(b) –I प्रभाव : यह इलेक्ट्रॉन आकर्षी समूह की उपस्थिति में होने वाला प्रभाव है | ऐसे समूह 3 डिग्री कार्बन से जुड़े हाइड्रोजन की तुलना में इलेक्ट्रॉन युग्म को प्रबल रूप से आकर्षित करते है |
N+R3 > N+H3 > NO2 > CN > COOH > F > Cl > Br > I